Unsur Periode 3
Natrium Na
Magnesium Mg
Aluminium Al
Silikon Si
Fosfor P
Belerang S
Klor Cl
Argon Ar
Halaman ini menggambarkan dan menjelaskan kecenderungan sifat-sifat atomik dan sifat-sifat fisik unsur-unsur periode 3 mulai dari natrium hingga argon. Hal yang dibahas meliputi energi ionisasi, jari-jari atom, elektronegativitas, daya hantar arus listrik, titik leleh dan titik didih.
Sifat-sifat Atomik
Struktur/konfigurasi elektronik
Pada periode 3 dalam tabel periodik, orbital 3s dan 3p terisi oleh elektron. Hanya sekedar mengingatkan, berikut versi singkat konfigurasi elektron untuk delapan unsur periode 3 adalah:
| Na | [Ne] 3s1 |
| Mg | [Ne] 3s2 |
| Al | [Ne] 3s2 3px1 |
| Si | [Ne] 3s2 3px1 3py1 |
| P | [Ne] 3s2 3px1 3py1 3pz1 |
| S | [Ne] 3s2 3px2 3py1 3pz1 |
| Cl | [Ne] 3s2 3px2 3py2 3pz1 |
| Ar | [Ne] 3s2 3px2 3py2 3pz2 |
Dalam tiap kasus, [Ne] menunjukkan struktur elektronik yang lengkap dari atom neon.
Energi ionisasi pertama
Energi ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan satu elektron yang terikat paling lemah dari satu mol atom dalam keadaan gas menjadi satu mol ion dalam keadaan gas dengan muatan +1.
Dibutuhkan energi untuk tiap perubahan 1 mol X.
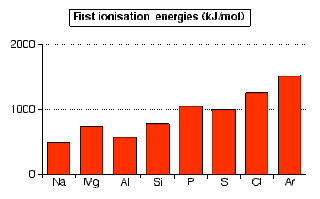
Pola perubahan energi ionisasi pertama unsur-unsur sepanjang periode 3.
Perhatikan bahwa secara umum kecenderungannya meningkat kecuali antara magnesium dan alumunium serta antara fosfor dan sulfur yang menurun
Penjelasan pola
Energi ionisasi pertama dipengaruhi oleh:
- Muatan dalam inti;
- Jarak elektron terluar dari inti;
- Banyaknya pemerisaian oleh elektron yang lebih dalam;
- Apakah elektron dalam orbital berpasangan atau tidak.
Kecenderungan meningkat
Dalam semua unsur-unsur periode 3, elektron terluar berada pada kulit orbital ke-3. Semuanya memiliki jarak yang sama dari inti / nukleus dan diperisai oleh elektron yang sama yaitu elektron pada kulit pertama dan kedua.
Perbedaan yang paling utama adalah meningkatnya jumlah proton dalam inti mulai dari natrium hingga argon. Hal inilah yang menyebabkan tarikan inti terhadap elektron terluarnya makin besar sehingga meningkatkan energi ionisasi.
Pada kenyataannya meningkatnya muatan di dalam inti juga akan menarik elektron terluar menjadi lebih dekat ke inti. Peningkatan energi ionisasi makin besar sepanjang periode dari kiri ke kanan.
Penurunan pada alumunium
Anda dapat memperkirakan bahwa ukuran alumunium lebih besar dari pada magnesium karena jumlah proton yang lebih banyak. Mengimbangi fakta bahwa elektron terluar dari alumunium berada pada orbital 3p bukannya 3s.
Elektron pada orbital 3p sedikit lebih jauh dari inti dari pada elektron pada orbital 3s, dan sebagian mendapatkan pemerisaian dari elektron 3s sebagai elektron yang lebih dalam. Kedua faktor inilah yang mengimbangi jumlah proton yang lebih banyak.
Penurunan pada sulfur
Pada fosfor ke sulfur, sesuatu yang lebih harus mengimbangi pengaruh proton yang lebih banyak.
Pemerisaian yang sama pada fosfor dan sulfur (dari elektron yang lebih dalam, pada beberapa tingkat dari elektron 3s), dan elektron yang akan dilepaskan berasal dari orbital yang sama.
Perbedaannya adalah bahwa pada sulfur, elektron yang akan dilepaskan berasal dari salah satu elektron yang berpasangan pada orbital 3px2. Tolakan antara 2 elektron yang berada dalam orbital yang sama menunjukkan bahwa elektron lebih mudah dikeluarkan dari pada elektron yang tidak berpasangan.
Jari-jari atom
Kecenderungan
Diagram di bawah ini menunjukkan bagaimana perubahan jari-jari atom pada unsur-unsur periode 3.
Gambaran yang digunakan untuk membuat diagram ini adalah berdasarkan pada:
- Jari-jari metalik / ionik untuk Na, Mg dan Al;
- Jari-jari kovalen untuk Si, P, S dan Cl;
- Jari-jari van der Waals untuk Ar, karena Ar tidak dapat membentuk ikatan yang kuat.
Wajar jika kita membandingkan jari-jari metalik dengan jari-jari kovalen karena keduanya menunjukkan ikatan yang sangat rapat. Akan tetapi tidak wajar bila kita membandingkan jari-jari metalik dan jari-jari kovalen dengan jari-jari van der Waals.
Kecenderungan secara umum menunjukkan atom makin kecil sepanjang periode TERKECUALI pada argon. Anda tidak dapat membandingkan hal yang tidak sejenis. Sebaiknya kita mengabaikan argon pada diskusi selanjutnya.
Penjelasan kecenderungan
Jari-jari metalik dan kovalen menunjukkan jarak dari inti ke pasangan elektron ikatan. Jika tidak yakin dengan hal itu, kembali dan ikuti link sebelumnya.
Dari natrium hingga klor, elektron ikatan semuanya berada di kulit ke-3, akan diperisai oleh elektron pada kulit pertama dan kedua. Peningkatan jumlah proton dalam inti sepanjang perioda akan meningkatkan tarikan elektron ikatan menjadi lebih dekat ke inti. Jumlah pemerisaian sama untuk semua unsur
Elektronegativitas / keelektronegatifan
Keelektronegatifan adalah ukuran kecenderungan atom untuk menarik pasangan elektron ikatan.
Skala Pauling adalah yang paling umum digunakan. Fluor (unsur yang paling elektronegatif) diberi skala 4.0 dan nilai ini makin menurun hingga cesium dan francium dengan keelektronegatifan terendah yaitu 0.7.
Kecenderungan
Kecenderungan sepanjang periode diperlihatkan grafik di bawah ini:
Ingat bahwa argon tidak dimasukkan. Keelektronegatifan adalah kecenderungan atom untuk menarik pasangan elektron ikatan. Karena argon tidak membentuk ikatan kovalen sehingga secara nyata tidak memiliki keelektronegatifan.
Penjelasan kecenderungan
Kecenderungan dijelaskan dengan cara yang sama seperti kecenderungan pada jari-jari atom. Sepanjang periode, elektron ikatan selalu berada pada kulit yang sama yaitu kulit ke-3, dan selalu diperisai oleh elektron dalam yang sama.
Semuanya berbeda dalam hal jumlah proton yang terus meningkat dan tarikan pasangan elektron ikatan makin mendekati inti.
Sifat-sifat Fisik
Bagian ini akan membahas daya hantar listrik serta titik leleh dan titik didih unsur-unsur periode 3. Untuk memahami hal ini, hal yang harus Anda pahami adalah struktur dari masing-masing unsur.
Struktur-struktur unsur
Struktur unsur-unsur berubah sepanjang periode 3. Tiga pertama merupakan metalik, silikon adalah kovalen raksasa dan sisanya berupa molekul sederhana.
Daya hantar arus listrik
- Natrium, magnesium dan alumunium semuanya merupakan penghantar / konduktor arus listrik yang baik;
- Silikon merupakan semikonduktor;
- Sisanya bukan merupakan konduktor.
Tiga logam pertama, sudah pasti merupakan penghantar listrik karena adanya delokalisasi elektron (“laut elektron�) yang bebas bergerak / berpindah sepanjang padatan atau cairan logam.
Pada kasus silikon, penjelasan bagaimana silikon dapat menjadi semikonduktor berada di luar cakupan tingkat ini. Dengan hanya mengetahui strukturnya seperti intan, kita tidak dapat memperkirakan silikon dapat menghantarkan arus listrik, tapi silikon memang dapat menghantarkan arus listrik.
Sisanya tidak menghantarkan arus listrik karena merupakan senyawa dengan molekul sederhana. Tidak ada elektron yang dapat bebas bergerak.
Titik leleh dan titik didih
Grafik di bawah menunjukkan bagaimana titik leleh dan titik didih unsur-unsur periode 3 berubah sepanjang periode. Gambar diplot dalam Kelvin bukannya °C untuk menghindari nilai yang negatif.
Lebih baik bila kita menghubungkan perubahan ini dengan terminologi macam-macam struktur yang telah dibahas.
Struktur metalik
Titik didih dan titik leleh meningkat sepanjang tiga logam pertama karena meningkatnya kekuatan ikatan metalik.
Jumlah elektron pada masing-masing atom menyumbang untuk meningkatkan delokalisasi “lautan elektron�. Atom-atom juga menjadi lebih kecil dan memiliki jumlah proton yang lebih banyak dari natrium hinggga magnesium dan alumunium.
Tarikan dan titik leleh serta titik didih meningkat karena:
- Inti atom memiliki muatan positif yang semakin besar;
- Lautan elektron makin bermuatan negatif;
- Lautan elektron makin dekat ke inti dan tertarik makin kuat.
Silikon
Silikon memiliki titik leleh dan titik didih yang lebih tinggi karena memiliki struktur kovalen raksasa. Kita harus memutuskan ikatan kovalen yang kuat itu sebelum akhirnya meleleh atau mendidih.
Karena yang kita bicarakan adalah tentang jenis ikatan yang berbeda, lebih baik jangan membendingkan langsung titik leleh dan titik didih silikon dengan titik leleh dan titik didih alumunium.
Empat unsur molekuler
Fosfor, sulfur, klor dan argon adalah senyawa molekuler sederhana yang hanya dipengaruhi
Ukuran titik leleh dan titik didih dipengaruhi oleh ukuran molekul.
Ingat struktur molekul:
Fosfor
Fosfor mengandung molekul P4. Untuk molekul fosfor, anda tidak dapat memecahkan ikatan kovalennya, hanya
Sulfur
Sulfur terdiri dari atom S8 yang berbentuk cincin. Molekulnya lebih besar dari pada molekul fosfor dan
Klor
Klor, Cl2, adalah molekul yang lebih kecil dengan
Argon
Molekul argon hanya terdiri dari satu atom argon, Ar. Jangkauan
*Artikel ini didapat dari berbagai sumber .



13 komentar:
woyyy,, maaf kalo jelek blog nya,, maklum,, baru belajar!!
hehehehee
sip2
good job...
keep posting....
mantapp
absen pak!!! wkwkwk
lumayan blognya tapi kurang enak dipandang neh...coba de cari layout yg bagus ato kasi background en gambar2 pendukung yg lebih menarik...pasti ciamik...
wew...asik tapi kurang indah
terima kasih komentar nya,, tapi kalo bisa yang berhubungan dengan bab ini ya .
mey katakan, Alhamdulilah cukup baik.... Tapi ada sedikit saran. Jangan marah yach!!!
Harus memperhatikan tampilan, ada kata-kata yang tidak bisa terbaca pada pembahasan sifat atomik. kemudian persaman yang menunjukan ionisasi tidak terbaca.
Pertanyan, "apa itu periode ketiga" tida cocok. Penjelasan di bawahnya terlalu banyak, bukan hanya menjelaskan apa itu periode ketiga tapi juga membahas bagaimana karakteristik unsur perioda ketiga.. Sebaiknya judulnya umum saja,misalanya "unsur-unsur perioda ketiga"
Di blog tidak dijelaskan kenapa unsur-unsur tersebut disebut peiode ketiga? Kenapa tidak membahas Sistem periodik unsur terlebih dahulu? Dimanakah letak perioda ketiga pada SPU? Sehingga pembaca bisa ebih mengerti
Bentuk fisik dari setiap unsur juga kurang dieksplor lebih detail.Misal wujudnya seperti apa, warnanya bagaimana.
Sebaiknya disajikan gambar-gambar mengenai unsur-unsur tersebut. Misalnya gambar aluminium secara fisik dan nyatanya seperti apa? Biar tidak abstrak pembaca tidak membayangkan.
apakah aluminium berupa padatan atau cairan? Warnanya seperti apa? Hal tersebut bisa disajikan lewat gambar.
Kenapa kecenderungan afinitas elektronnya tidak dibahas? terasa kurang lengkap. Apabila membahas jari-jari, keelektronegatifan dan energi ionisasi, sebaiknya dilengkap dengan afinitas elektronya juga...
ouh , terima kasih atas komentarnya .
ya , insya alloh akan diperbaiki lg .
terima kasih bnyk .
mudah - mudahan itu menjadi masukan buat kami agar lebih baik lg .
boleh tanya?
disana dijelaskan bahwa kecenderungan energi ionisasi pada perioda tiga adalah meningkat. tapi pada magnesium dan alumunium serta fosfor dan sulfur menurun.
apa yang mempengaruhi hal itu?
terima kasih atas pertanyaan nya.
disana di jelaskan bahwa allumunium mengalami penurunan energi ionisasi.
Anda dapat memperkirakan bahwa ukuran alumunium lebih besar dari pada magnesium karena jumlah proton yang lebih banyak. Mengimbangi fakta bahwa elektron terluar dari alumunium berada pada orbital 3p bukannya 3s.
Elektron pada orbital 3p sedikit lebih jauh dari inti dari pada elektron pada orbital 3s, dan sebagian mendapatkan pemerisaian dari elektron 3s sebagai elektron yang lebih dalam. Kedua faktor inilah yang mengimbangi jumlah proton yang lebih banyak.
Penurunan pada sulfur
Pada fosfor ke sulfur, sesuatu yang lebih harus mengimbangi pengaruh proton yang lebih banyak.
Pemerisaian yang sama pada fosfor dan sulfur (dari elektron yang lebih dalam, pada beberapa tingkat dari elektron 3s), dan elektron yang akan dilepaskan berasal dari orbital yang sama.
Perbedaannya adalah bahwa pTolakan antara 2 elektron yang berada dalam orbital yang sama menunjukkan bahwa elektron lebih mudah dikeluarkan dari pada elektron yang tidak berpasangan.
Assalamu'alaikum Warahmatullah Wabarakatuh..:)
tuk Adek2ku yang full semngat & kreatif...!!!
Luar biasa blognya... mengulas Unsur Kimia periode Ketiga...Mumtazzz...
lebih Dahsyat lagi... klo ada anmimasi ato visualisasi tentang tema2 yg di post... kyanya bakala lbih mnarik...
Keep Istiqamah... niatkan segalanya karena Allah Semata...Semoga Allah memudahkan dalam setiap langkahnya.. Amien.. man jadda wa jadda...
Wassalamu'alaikum warahmatullah wabarakatuh..:)
terima kasih untuk postingan yang bermanfaat ini :D
Posting Komentar